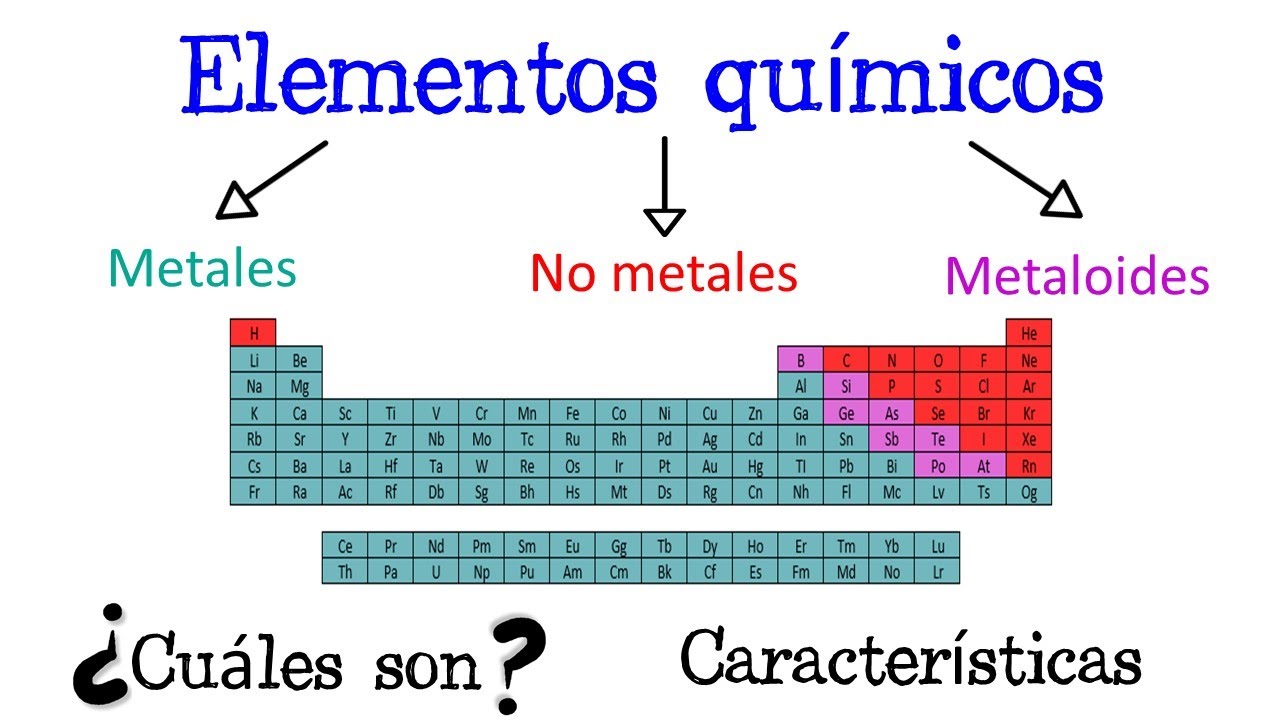
Tabla Periódica: Metales, No Metales y Metaloides Explicados
La tabla periódica es una de las herramientas más emblemáticas de la química, un verdadero mapa del mundo atómico que nos permite entender la composición de la materia. ¿Te has preguntado alguna vez qué diferencias existen entre los metales, no metales y metaloides? Este artículo te llevará a un recorrido fascinante por estos tres grupos, explorando sus propiedades, usos y características. Comprender la tabla periódica no solo es fundamental para estudiantes y profesionales de la química, sino también para cualquier persona interesada en la ciencia y su aplicación en la vida cotidiana. A lo largo de este texto, desglosaremos cada categoría, proporcionaremos ejemplos concretos y responderemos a preguntas comunes que pueden surgir al estudiar este tema. Prepárate para adentrarte en el mundo de los elementos químicos y descubrir la rica diversidad que ofrece la tabla periódica.
1. La Estructura de la Tabla Periódica
Antes de sumergirnos en los metales, no metales y metaloides, es importante entender cómo está organizada la tabla periódica. Esta disposición no es aleatoria; se basa en la configuración electrónica de los elementos y sus propiedades químicas. La tabla se divide en filas horizontales llamadas periodos y columnas verticales conocidas como grupos o familias.
1.1. Grupos y Periodos
Los elementos en un mismo grupo comparten propiedades similares debido a la configuración de sus electrones de valencia. Por ejemplo, los elementos del grupo 1, como el litio y el sodio, son metales altamente reactivos. Por otro lado, los elementos de un mismo periodo muestran tendencias en sus propiedades a medida que avanzamos de izquierda a derecha. Por ejemplo, la electronegatividad y la energía de ionización tienden a aumentar.
1.2. Clasificación de los Elementos
En la tabla periódica, los elementos se clasifican en metales, no metales y metaloides. Esta clasificación es esencial para entender cómo se comportan los elementos en reacciones químicas y sus aplicaciones en la vida diaria. Cada categoría tiene características únicas que los distinguen, lo que facilita su estudio y comprensión.
2. Metales: Características y Usos
Los metales son conocidos por su alta conductividad eléctrica y térmica, así como por su maleabilidad y ductilidad. Estos elementos, que constituyen la mayor parte de la tabla periódica, se encuentran a la izquierda y en el centro. Algunos ejemplos de metales incluyen el hierro, el cobre y el oro.
2.1. Propiedades de los Metales
Los metales poseen características físicas y químicas que los hacen únicos. En general, son sólidos a temperatura ambiente (con la excepción del mercurio), tienen un brillo metálico y son buenos conductores de electricidad. Su capacidad para perder electrones durante las reacciones químicas los convierte en buenos reductores. Por ejemplo, el sodio es un metal que reacciona violentamente con el agua, liberando hidrógeno y formando hidróxido de sodio.
2.2. Aplicaciones Comunes
Los metales tienen una amplia gama de aplicaciones en nuestra vida diaria. Se utilizan en la construcción (acero), en la fabricación de dispositivos electrónicos (cobre) y en la joyería (oro y plata). Además, los metales son fundamentales en la industria automotriz y aeroespacial, donde se valoran por su resistencia y durabilidad.
3. No Metales: Características y Usos
Los no metales, en contraste con los metales, se encuentran a la derecha de la tabla periódica. Son elementos que, en su mayoría, no conducen la electricidad y presentan propiedades químicas muy diferentes. Ejemplos comunes de no metales son el oxígeno, el nitrógeno y el carbono.
3.1. Propiedades de los No Metales
Los no metales suelen ser gases o sólidos frágiles a temperatura ambiente. A diferencia de los metales, son malos conductores de calor y electricidad. Además, tienden a ganar electrones en reacciones químicas, convirtiéndose en aniones. Por ejemplo, el cloro se combina con sodio para formar cloruro de sodio, o sal común.
3.2. Aplicaciones Comunes
Los no metales son esenciales para la vida y tienen múltiples aplicaciones. El oxígeno es vital para la respiración, mientras que el carbono es la base de la química orgánica. Otros no metales, como el azufre, se utilizan en la fabricación de fertilizantes y productos químicos industriales. Sin duda, su presencia es fundamental en numerosos procesos biológicos y tecnológicos.
4. Metaloides: La Línea Divisoria
Los metaloides, que se encuentran en la tabla periódica en una línea diagonal entre los metales y no metales, presentan propiedades intermedias. Elementos como el silicio, el arsénico y el boro son ejemplos de metaloides, que tienen características tanto de metales como de no metales.
4.1. Propiedades de los Metaloides
Los metaloides suelen ser semiconductores, lo que significa que pueden conducir electricidad, pero no tan bien como los metales. Esta propiedad los hace especialmente útiles en la industria de la electrónica. Por ejemplo, el silicio es un componente clave en la fabricación de chips de computadora. Además, los metaloides pueden formar aleaciones con metales, lo que les permite mejorar ciertas propiedades mecánicas.
4.2. Aplicaciones Comunes
Los metaloides tienen aplicaciones diversas y son esenciales en la tecnología moderna. El silicio, como se mencionó, se utiliza en dispositivos electrónicos y paneles solares. El arsénico se utiliza en la fabricación de semiconductores y en tratamientos médicos. Su versatilidad y propiedades únicas los convierten en elementos valiosos en la ciencia y la industria.
5. Comparación entre Metales, No Metales y Metaloides
Ahora que hemos explorado cada grupo, es interesante comparar sus propiedades y aplicaciones. Esta comparación no solo nos ayuda a entender mejor la tabla periódica, sino que también resalta la importancia de cada categoría en diferentes contextos.
5.1. Propiedades Físicas y Químicas
Los metales son buenos conductores de electricidad, mientras que los no metales son aislantes. Los metaloides, por su parte, son semiconductores, lo que les permite actuar como intermediarios. En términos de reactividad, los metales tienden a perder electrones, mientras que los no metales tienden a ganarlos. Los metaloides pueden comportarse como metales o no metales, dependiendo de las condiciones.
5.2. Usos en la Vida Diaria
Los metales son fundamentales en la construcción y la fabricación de productos duraderos, mientras que los no metales son cruciales para procesos biológicos y químicos. Los metaloides, por su parte, son esenciales en la tecnología moderna, especialmente en la electrónica. Cada grupo juega un papel vital en nuestra vida cotidiana, lo que resalta la importancia de comprender sus características.
6. Importancia de la Tabla Periódica en la Ciencia
La tabla periódica no solo es una herramienta educativa, sino que también es fundamental en la investigación científica. Proporciona un marco para entender las relaciones entre diferentes elementos y sus compuestos. Además, la organización de los elementos permite a los científicos predecir el comportamiento químico de sustancias nuevas.
6.1. Investigación y Descubrimientos
La tabla periódica ha sido crucial en el descubrimiento de nuevos elementos y compuestos. A medida que se desarrollan nuevas técnicas y tecnologías, los científicos pueden explorar la tabla de maneras innovadoras. Por ejemplo, la síntesis de nuevos materiales en la industria de la nanotecnología a menudo se basa en la comprensión de las propiedades de los elementos en la tabla periódica.
6.2. Educación y Comprensión
En el ámbito educativo, la tabla periódica es una herramienta invaluable. Permite a los estudiantes visualizar la relación entre diferentes elementos y comprender conceptos fundamentales en química. Además, el estudio de la tabla periódica fomenta el pensamiento crítico y la curiosidad científica, habilidades que son esenciales en el mundo actual.
Preguntas Frecuentes (FAQ)
¿Qué son los metales y cuáles son sus principales características?
Los metales son elementos que generalmente son sólidos a temperatura ambiente, con excepción del mercurio. Se caracterizan por su alta conductividad eléctrica y térmica, su brillo metálico y su capacidad para ser moldeados. Ejemplos comunes incluyen el hierro, el cobre y el oro. Los metales tienden a perder electrones en reacciones químicas, lo que les convierte en buenos reductores.
¿Cuáles son las diferencias clave entre metales y no metales?
Los metales se encuentran a la izquierda de la tabla periódica y son buenos conductores de electricidad, mientras que los no metales están a la derecha y son generalmente malos conductores. Los metales tienden a perder electrones, mientras que los no metales tienden a ganarlos. Además, los metales suelen ser sólidos y maleables, mientras que los no metales pueden ser gases o sólidos frágiles.
¿Qué son los metaloides y por qué son importantes?
Los metaloides son elementos que presentan propiedades intermedias entre metales y no metales. Son importantes porque actúan como semiconductores, lo que los hace esenciales en la industria electrónica. Elementos como el silicio y el arsénico son ejemplos de metaloides que tienen aplicaciones en tecnología moderna, como en la fabricación de chips y dispositivos electrónicos.
¿Cómo se organiza la tabla periódica?
La tabla periódica está organizada en filas horizontales llamadas periodos y columnas verticales conocidas como grupos o familias. Los elementos se agrupan según sus propiedades químicas y la configuración de sus electrones. Esta organización permite a los científicos predecir el comportamiento de los elementos y sus compuestos en reacciones químicas.
¿Por qué es importante la tabla periódica en la educación científica?
La tabla periódica es fundamental en la educación científica porque proporciona una representación visual de los elementos y sus relaciones. Facilita la comprensión de conceptos químicos básicos y fomenta el pensamiento crítico. Además, ayuda a los estudiantes a visualizar patrones y tendencias en las propiedades de los elementos, lo que es crucial para su aprendizaje en química.
¿Qué aplicaciones tienen los metales en la vida cotidiana?
Los metales tienen numerosas aplicaciones en nuestra vida diaria. Se utilizan en la construcción (acero), en la fabricación de dispositivos electrónicos (cobre) y en la joyería (oro y plata). Además, son esenciales en la industria automotriz y aeroespacial, donde se valoran por su resistencia y durabilidad. Sin duda, los metales son componentes clave en la mayoría de los productos que utilizamos a diario.
¿Cómo se relacionan los elementos de la tabla periódica entre sí?
Los elementos de la tabla periódica están relacionados entre sí a través de sus propiedades químicas y físicas. Los elementos en un mismo grupo comparten características similares debido a la configuración de sus electrones de valencia, mientras que aquellos en un mismo periodo muestran tendencias en propiedades a medida que avanzamos de izquierda a derecha. Esta relación permite a los científicos predecir cómo reaccionarán diferentes elementos entre sí.