¿Qué Tipo de Propiedad es el Punto de Ebullición? Descubre su Clasificación y Características
El punto de ebullición es una propiedad física fundamental que juega un papel crucial en la química y en la vida cotidiana. Desde la cocción de alimentos hasta procesos industriales, entender qué tipo de propiedad es el punto de ebullición puede ofrecerte una nueva perspectiva sobre cómo funcionan las sustancias a diferentes temperaturas. Pero, ¿sabías que el punto de ebullición no solo es un número en una tabla? Tiene implicaciones significativas en la forma en que los materiales interactúan y se comportan bajo diversas condiciones. En este artículo, exploraremos la clasificación y características del punto de ebullición, desglosando sus aspectos más relevantes y cómo se relaciona con otras propiedades físicas y químicas. Acompáñanos en este viaje para descubrir la importancia del punto de ebullición y su clasificación dentro del amplio mundo de las propiedades de la materia.
¿Qué es el Punto de Ebullición?
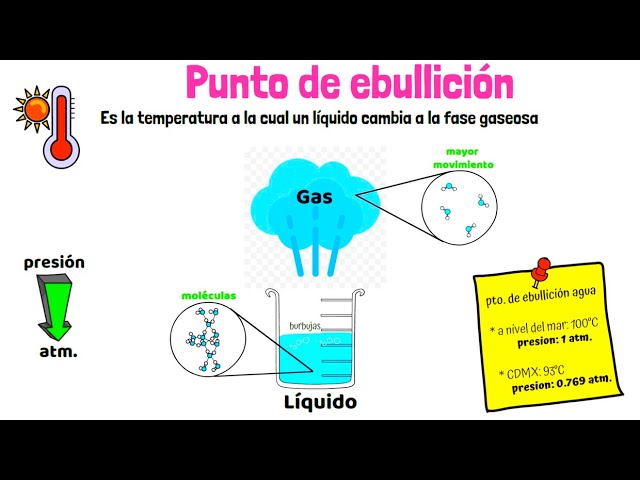
El punto de ebullición se define como la temperatura a la cual un líquido se convierte en vapor. Este proceso ocurre cuando la presión de vapor del líquido iguala la presión atmosférica. En otras palabras, es el momento en que las moléculas en la superficie del líquido tienen suficiente energía para superar las fuerzas de atracción que las mantienen unidas. Este fenómeno no es solo un aspecto técnico; tiene múltiples aplicaciones prácticas, desde la destilación de líquidos hasta la preparación de alimentos.
Características del Punto de Ebullición
El punto de ebullición de una sustancia puede variar según diversos factores, entre ellos:
- Presión atmosférica: A mayor altitud, la presión atmosférica disminuye, lo que provoca que el punto de ebullición también disminuya. Por ejemplo, el agua hierve a 100 °C al nivel del mar, pero a más de 3000 metros de altura, puede hacerlo a solo 90 °C.
- Composición química: Cada sustancia tiene un punto de ebullición único, determinado por la fuerza de sus enlaces intermoleculares. Por ejemplo, el agua (H₂O) tiene un punto de ebullición de 100 °C, mientras que el etanol (C₂H₅OH) hierve a 78.37 °C.
- Impurezas: La presencia de solutos en un líquido puede alterar su punto de ebullición. Este fenómeno se conoce como elevación del punto de ebullición y es fundamental en la química de soluciones.
Ejemplos Prácticos
Para ilustrar la importancia del punto de ebullición, consideremos dos ejemplos. Primero, en la cocina, al hervir agua para preparar pasta, sabemos que el agua debe alcanzar los 100 °C para que la pasta se cocine adecuadamente. Sin embargo, si estamos en una ciudad de alta montaña, como La Paz en Bolivia, el agua puede hervir a temperaturas más bajas, lo que afecta el tiempo de cocción.
En segundo lugar, en la industria química, el proceso de destilación se basa en las diferencias de puntos de ebullición para separar componentes de una mezcla. Por ejemplo, en la refinación del petróleo, se utilizan columnas de destilación para separar los distintos hidrocarburos según sus puntos de ebullición.
Clasificación del Punto de Ebullición
El punto de ebullición se puede clasificar en dos categorías principales: punto de ebullición normal y punto de ebullición a presión variable.
Punto de Ebullición Normal
El punto de ebullición normal se refiere a la temperatura a la cual una sustancia hierve a una presión atmosférica de 1 atmósfera (atm). Este es el punto de referencia comúnmente utilizado en laboratorios y literatura científica. Por ejemplo, el punto de ebullición normal del agua es de 100 °C.
Esta medida es crucial para la estandarización en experimentos y procesos industriales. Cuando se habla del punto de ebullición de una sustancia, generalmente se hace referencia a este valor, ya que proporciona una base consistente para comparar diferentes sustancias.
Punto de Ebullición a Presión Variable
Por otro lado, el punto de ebullición a presión variable se refiere a cómo cambia el punto de ebullición de una sustancia bajo diferentes presiones atmosféricas. Este concepto es esencial en situaciones donde la presión no es constante, como en la cocina a presión o en procesos industriales que ocurren a altas presiones.
Un ejemplo claro es el uso de ollas de presión en la cocina. Al aumentar la presión dentro de la olla, el punto de ebullición del agua se eleva, permitiendo que los alimentos se cocinen más rápidamente. Este principio se aplica también en la industria, donde se utilizan condiciones controladas para maximizar la eficiencia de los procesos químicos.
Relación con Otras Propiedades Físicas
El punto de ebullición no existe en el vacío; está íntimamente relacionado con otras propiedades físicas de las sustancias. Estas relaciones son fundamentales para entender el comportamiento de los materiales en diversas condiciones.
Interacción con la Presión de Vapor
La presión de vapor es la presión ejercida por un vapor en equilibrio con su líquido a una temperatura dada. A medida que la temperatura de un líquido aumenta, su presión de vapor también lo hace. El punto de ebullición se alcanza cuando esta presión de vapor iguala la presión externa. Por lo tanto, una sustancia con una alta presión de vapor a temperatura ambiente generalmente tendrá un punto de ebullición bajo, como es el caso de los solventes orgánicos volátiles.
Relación con la Temperatura de Fusión
El punto de ebullición también puede relacionarse con el punto de fusión de una sustancia. En general, las sustancias con enlaces intermoleculares fuertes, como los sólidos iónicos, tienen puntos de fusión y ebullición elevados. Por ejemplo, el cloruro de sodio (sal de mesa) tiene un alto punto de fusión y un alto punto de ebullición debido a la fuerza de sus enlaces iónicos. En contraste, los líquidos con enlaces débiles, como el metanol, tienen puntos de fusión y ebullición más bajos.
Factores que Afectan el Punto de Ebullición
Varios factores pueden influir en el punto de ebullición de una sustancia, y comprender estos elementos es clave para manipular y utilizar correctamente los líquidos en diferentes aplicaciones.
Enlaces Intermoleculares
Los enlaces intermoleculares son fuerzas que mantienen unidas a las moléculas en un líquido. Existen varios tipos de enlaces, como los enlaces de hidrógeno, las fuerzas de Van der Waals y los enlaces iónicos. Los líquidos que presentan enlaces de hidrógeno, como el agua, generalmente tienen puntos de ebullición más altos debido a la fuerza de estas interacciones. En comparación, líquidos como el benceno, que tienen fuerzas de Van der Waals más débiles, hierve a temperaturas más bajas.
Composición Química
La composición química de una sustancia también afecta su punto de ebullición. Por ejemplo, los alcoholes, que contienen grupos hidroxilo (-OH), tienden a tener puntos de ebullición más altos que los hidrocarburos de peso molecular similar debido a la capacidad de formar enlaces de hidrógeno. Esta diferencia es importante al seleccionar solventes en laboratorios y procesos industriales.
Aplicaciones Prácticas del Punto de Ebullición
El conocimiento del punto de ebullición tiene múltiples aplicaciones en la vida cotidiana y en la industria. Desde la cocina hasta la fabricación de productos químicos, su importancia es innegable.
Cocina y Gastronomía
En la cocina, el punto de ebullición es esencial para preparar alimentos. Conocer el punto de ebullición del agua permite ajustar tiempos de cocción y técnicas, como el escaldado o la cocción al vapor. Además, la comprensión de cómo las impurezas afectan el punto de ebullición puede influir en la preparación de soluciones, como en la elaboración de jarabes o salsas.
Industria Química
En la industria química, el punto de ebullición se utiliza para diseñar procesos de separación, como la destilación y la extracción. La capacidad de separar componentes de una mezcla en función de sus puntos de ebullición permite la producción de productos químicos puros y la eliminación de impurezas. Esta técnica es fundamental en la producción de combustibles, productos farmacéuticos y alimentos.
Preguntas Frecuentes (FAQ)
1. ¿El punto de ebullición es el mismo en todo el mundo?
No, el punto de ebullición de una sustancia puede variar según la presión atmosférica. Por ejemplo, el agua hierve a 100 °C al nivel del mar, pero a mayor altitud, como en montañas, su punto de ebullición disminuye debido a la menor presión atmosférica.
2. ¿Cómo afecta la sal al punto de ebullición del agua?
La sal, al ser un soluto, eleva el punto de ebullición del agua. Este fenómeno se conoce como elevación del punto de ebullición. Por lo tanto, al añadir sal al agua, se requiere una temperatura más alta para que el agua hierva.
3. ¿Qué es la destilación y cómo se relaciona con el punto de ebullición?
La destilación es un proceso que separa componentes de una mezcla basándose en sus puntos de ebullición. Al calentar la mezcla, los componentes con puntos de ebullición más bajos se evaporan primero, permitiendo su recolección y separación de los demás componentes.
4. ¿Por qué el punto de ebullición del etanol es más bajo que el del agua?
El etanol tiene un punto de ebullición más bajo que el agua debido a que sus enlaces intermoleculares (fuerzas de hidrógeno) son menos fuertes que los del agua. Esto significa que se requiere menos energía para que las moléculas de etanol superen estas fuerzas y pasen al estado gaseoso.
5. ¿Qué sustancias tienen puntos de ebullición extremadamente altos?
Sustancias como el tungsteno y el carbono en forma de grafito tienen puntos de ebullición extremadamente altos, debido a sus fuertes enlaces covalentes. Estos materiales son utilizados en aplicaciones donde se requieren altas temperaturas, como en la fabricación de herramientas y componentes electrónicos.
6. ¿El punto de ebullición puede preverse a partir de la estructura molecular?
Sí, la estructura molecular de una sustancia puede ayudar a predecir su punto de ebullición. Las moléculas con enlaces más fuertes o estructuras que permiten interacciones más fuertes entre ellas tienden a tener puntos de ebullición más altos.
7. ¿Cómo se mide el punto de ebullición?
El punto de ebullición se mide calentando una muestra de líquido y observando la temperatura en la que comienza a hervir. Para obtener resultados precisos, es importante realizar la medición a una presión atmosférica constante, generalmente a 1 atmósfera.