Cómo se Manifiesta la Energía en una Reacción Química: Conceptos Clave y Ejemplos Explicativos
La energía es un concepto fundamental en la química, ya que todas las reacciones químicas implican cambios energéticos. Desde la combustión de un combustible hasta la fotosíntesis en las plantas, la energía se transforma y se manifiesta de diversas maneras. Comprender cómo se manifiesta la energía en una reacción química no solo es fascinante, sino que también es esencial para aplicaciones prácticas en campos como la ingeniería, la biología y la sostenibilidad. En este artículo, exploraremos los conceptos clave relacionados con la energía en reacciones químicas, abordando tanto las teorías fundamentales como ejemplos ilustrativos que ayudarán a clarificar estos principios. A medida que avancemos, descubrirás cómo la energía se transforma, se almacena y se libera, así como los diferentes tipos de reacciones que podemos encontrar en la naturaleza y en nuestras vidas diarias.
1. Conceptos Fundamentales de Energía Química
La energía en una reacción química se puede entender a través de varios conceptos fundamentales. La energía química se refiere a la energía almacenada en los enlaces de los compuestos químicos. Cuando se rompen estos enlaces, la energía se libera o se absorbe, dependiendo del tipo de reacción. A continuación, se presentan algunos conceptos clave que son esenciales para comprender cómo se manifiesta la energía en una reacción química.
1.1. Energía Potencial y Energía Cinética
La energía en el contexto químico se puede dividir en dos categorías principales: energía potencial y energía cinética. La energía potencial es la energía almacenada en un sistema, mientras que la energía cinética es la energía del movimiento. En una reacción química, la energía potencial se encuentra en los enlaces entre átomos. Cuando los enlaces se rompen y se forman nuevos enlaces, la energía puede ser liberada (exotérmica) o absorbida (endotérmica).
Por ejemplo, durante la combustión de un hidrocarburo, como la gasolina, los enlaces entre los átomos de carbono e hidrógeno se rompen y se forman nuevos enlaces con el oxígeno, liberando una gran cantidad de energía en forma de calor y luz. Este proceso es un claro ejemplo de cómo la energía potencial se transforma en energía cinética.
1.2. Ley de Conservación de la Energía
La ley de conservación de la energía es un principio fundamental en la química y la física. Esta ley establece que la energía no se crea ni se destruye, sino que se transforma de una forma a otra. En el contexto de las reacciones químicas, esto significa que la energía total de los reactivos debe ser igual a la energía total de los productos, considerando cualquier energía que se libere o se absorba durante la reacción.
Por ejemplo, en una reacción de neutralización entre un ácido y una base, la energía se libera en forma de calor, pero la cantidad total de energía en el sistema permanece constante. Este principio es crucial para entender cómo se manifiesta la energía en las reacciones químicas y cómo podemos predecir el comportamiento de los sistemas químicos.
1.3. Entalpía y Cambios de Energía
La entalpía es una medida de la energía total de un sistema, que incluye tanto la energía interna como el trabajo realizado por el sistema. En una reacción química, el cambio de entalpía (ΔH) nos indica si la reacción es exotérmica (libera energía) o endotérmica (absorbe energía). Un cambio de entalpía negativo indica que se libera energía al medio ambiente, mientras que un cambio positivo indica que se requiere energía del medio ambiente.
Un ejemplo clásico de una reacción exotérmica es la combustión del metano (CH₄). La reacción libera energía en forma de calor y luz, lo que se puede medir como un cambio de entalpía negativo. En contraste, la fotosíntesis es un proceso endotérmico que absorbe energía solar para convertir el dióxido de carbono y el agua en glucosa y oxígeno, resultando en un cambio de entalpía positivo.
2. Tipos de Reacciones Químicas y su Relación con la Energía
Las reacciones químicas se pueden clasificar de diversas maneras, y cada tipo de reacción tiene características únicas en cuanto a cómo se manifiesta la energía. A continuación, exploraremos los tipos más comunes de reacciones y cómo se relacionan con la energía.
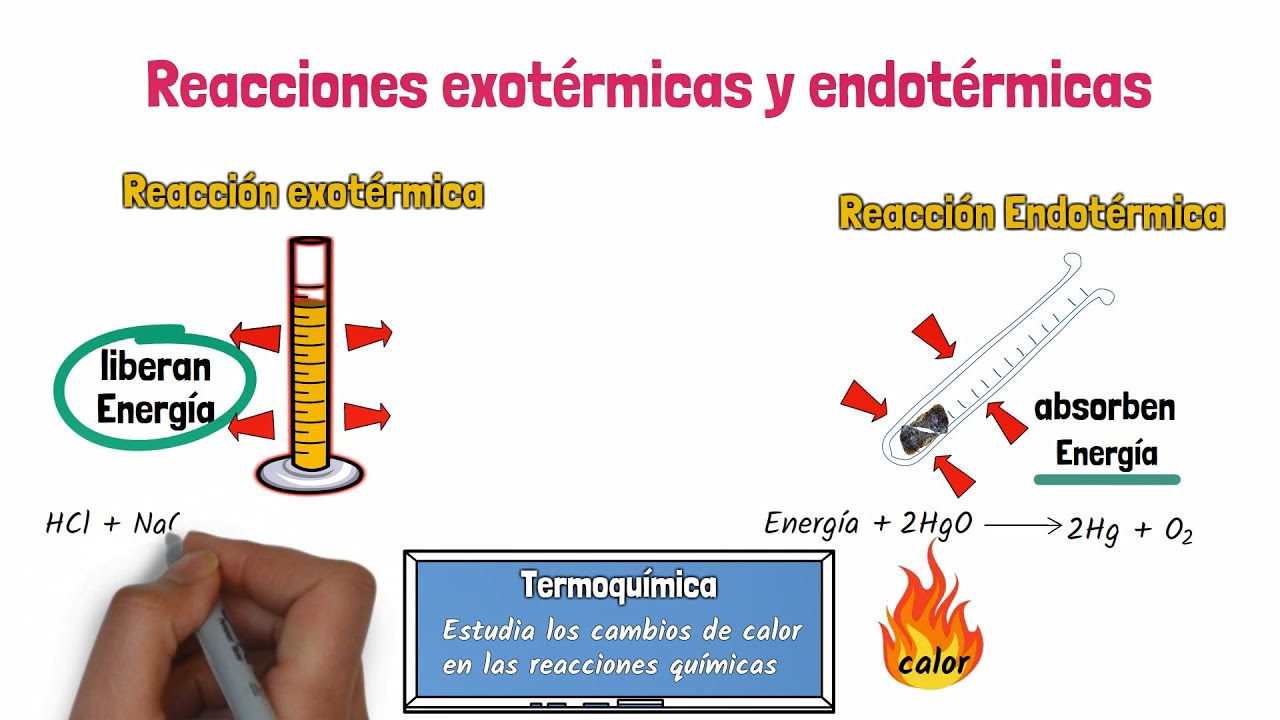
2.1. Reacciones Exotérmicas
Las reacciones exotérmicas son aquellas que liberan energía al entorno. Este tipo de reacciones es común en procesos como la combustión y la oxidación. Durante estas reacciones, la energía almacenada en los enlaces químicos de los reactivos se libera, generalmente en forma de calor y luz.
Un ejemplo notable es la combustión del carbón. Cuando el carbón se quema, los enlaces entre los átomos de carbono se rompen y se forman nuevos enlaces con el oxígeno, liberando energía. Esta energía se utiliza en la generación de electricidad en centrales eléctricas, donde el calor producido se convierte en energía eléctrica.
2.2. Reacciones Endotérmicas
Las reacciones endotérmicas, en contraste, requieren energía del entorno para llevarse a cabo. Este tipo de reacciones absorbe calor, lo que puede resultar en una disminución de la temperatura del entorno inmediato. Un ejemplo clásico de una reacción endotérmica es la disolución de sal en agua. Cuando la sal se disuelve, se requiere energía para romper los enlaces iónicos entre los átomos de sodio y cloro, lo que provoca una disminución de la temperatura del agua.
Otro ejemplo es la fotosíntesis, donde las plantas absorben energía solar para convertir dióxido de carbono y agua en glucosa y oxígeno. Este proceso es fundamental para la vida en la Tierra, ya que proporciona la base de la cadena alimentaria.
2.3. Reacciones de Oxidación-Reducción
Las reacciones de oxidación-reducción, o redox, implican la transferencia de electrones entre sustancias. Estas reacciones son fundamentales en procesos biológicos y industriales, y a menudo están acompañadas de cambios significativos en la energía. Por ejemplo, en la respiración celular, la glucosa se oxida, liberando energía que las células utilizan para llevar a cabo sus funciones vitales.
En este tipo de reacciones, la energía se manifiesta en la forma de ATP (adenosín trifosfato), que es la principal fuente de energía en las células. La comprensión de las reacciones redox es crucial para el desarrollo de baterías y celdas de combustible, donde la energía química se convierte en energía eléctrica.
3. El Papel de la Energía en la Velocidad de Reacción
La energía no solo influye en el tipo de reacción química, sino también en la velocidad a la que ocurre. La cinética química es el estudio de las tasas de reacción y los factores que las afectan. La energía de activación es un concepto clave en este contexto, ya que se refiere a la cantidad de energía necesaria para iniciar una reacción.
3.1. Energía de Activación
La energía de activación es la barrera energética que los reactivos deben superar para convertirse en productos. Cuanto mayor sea la energía de activación, más lenta será la reacción. Por ejemplo, en la combustión de combustibles, la chispa inicial proporciona la energía necesaria para iniciar la reacción. Sin esa chispa, el combustible no se quemaría, independientemente de la cantidad de oxígeno disponible.
Un ejemplo cotidiano es el encendido de un fósforo. Al frotar el fósforo, se genera suficiente energía para superar la energía de activación y permitir que el fósforo se encienda. Una vez que se inicia la reacción, la energía liberada permite que continúe la combustión.
3.2. Catalizadores
Los catalizadores son sustancias que aumentan la velocidad de una reacción química al reducir la energía de activación. Esto significa que se necesita menos energía para que los reactivos se conviertan en productos, lo que acelera la reacción. Un ejemplo común de un catalizador es el platino en la reacción de combustión de los motores de automóviles, que ayuda a reducir las emisiones nocivas.
Los catalizadores son esenciales en muchos procesos industriales, como la producción de amoníaco en el proceso Haber-Bosch, donde se utiliza un catalizador de hierro para aumentar la velocidad de la reacción entre el nitrógeno y el hidrógeno.
3.3. Factores que Afectan la Velocidad de Reacción
Además de la energía de activación, varios factores afectan la velocidad de una reacción química, como la concentración de los reactivos, la temperatura y la superficie de contacto. Aumentar la temperatura generalmente aumenta la energía cinética de las moléculas, lo que incrementa la frecuencia y la energía de las colisiones entre reactivos, acelerando así la reacción.
Por ejemplo, al calentar una mezcla de reactivos, se incrementa la velocidad de reacción, lo que se puede observar en la cocción de alimentos. En la cocina, al hervir agua, se acelera la cocción de los alimentos debido al aumento de temperatura, que proporciona más energía a las moléculas de agua.
4. Energía en Reacciones Biológicas
La energía también juega un papel crucial en las reacciones biológicas, donde los organismos convierten la energía química en formas utilizables para mantener la vida. Estas reacciones son fundamentales para procesos como la respiración y la fotosíntesis.
4.1. Respiración Celular
La respiración celular es el proceso mediante el cual las células obtienen energía al descomponer la glucosa en presencia de oxígeno. Este proceso se divide en varias etapas, incluyendo la glucólisis, el ciclo de Krebs y la cadena de transporte de electrones. Cada una de estas etapas libera energía en forma de ATP.
Durante la respiración, la energía química almacenada en los enlaces de la glucosa se libera y se convierte en ATP, que las células utilizan para realizar trabajo. Este proceso es esencial para el funcionamiento de todos los organismos vivos, desde las células más simples hasta los organismos multicelulares.
4.2. Fotosíntesis
La fotosíntesis es el proceso mediante el cual las plantas, algas y algunas bacterias convierten la energía solar en energía química. Utilizando la clorofila, estos organismos absorben la luz solar y la utilizan para convertir el dióxido de carbono y el agua en glucosa y oxígeno. Este proceso es fundamental para la vida en la Tierra, ya que proporciona el oxígeno que respiramos y la base de la cadena alimentaria.
La energía solar se almacena en los enlaces de la glucosa, que puede ser utilizada posteriormente por las plantas o consumida por otros organismos. Este ciclo de energía es un ejemplo perfecto de cómo la energía se manifiesta en reacciones biológicas, manteniendo el equilibrio en los ecosistemas.
4.3. Energía y Metabolismo
El metabolismo es el conjunto de reacciones químicas que ocurren en un organismo para mantener la vida. Estas reacciones incluyen tanto procesos catabólicos (que liberan energía al descomponer moléculas) como anabólicos (que requieren energía para construir moléculas). La energía en el metabolismo se gestiona a través de rutas metabólicas complejas que aseguran que las células obtengan la energía que necesitan para funcionar.
La regulación del metabolismo es crucial para la salud. Por ejemplo, un desequilibrio en las reacciones metabólicas puede llevar a enfermedades como la diabetes, donde la capacidad del cuerpo para manejar la glucosa se ve comprometida, afectando la producción y el uso de energía.
5. Aplicaciones Prácticas de la Energía en Reacciones Químicas
La comprensión de cómo se manifiesta la energía en las reacciones químicas tiene aplicaciones prácticas en numerosos campos. Desde la industria hasta la medicina, la manipulación de la energía en reacciones químicas puede tener un impacto significativo en nuestras vidas.
5.1. Energías Renovables
El desarrollo de energías renovables se basa en la comprensión de las reacciones químicas. Por ejemplo, las celdas de combustible convierten la energía química del hidrógeno en electricidad a través de reacciones de oxidación-reducción. Este proceso no solo es eficiente, sino que también produce agua como subproducto, lo que lo convierte en una alternativa sostenible a los combustibles fósiles.
Además, la energía solar se captura a través de paneles solares, donde las reacciones químicas en materiales semiconductores convierten la luz solar en energía eléctrica. Esta tecnología está en constante evolución, y la investigación en este campo busca mejorar la eficiencia y la viabilidad económica de las energías renovables.
5.2. Medicina y Farmacología
En medicina, la comprensión de cómo se manifiesta la energía en las reacciones químicas es fundamental para el desarrollo de nuevos fármacos. Muchas terapias se basan en reacciones químicas específicas que afectan procesos biológicos. Por ejemplo, los medicamentos que inhiben ciertas enzimas pueden alterar el metabolismo de una enfermedad, lo que puede resultar en un tratamiento efectivo.
Además, la investigación en biomedicina a menudo involucra el estudio de reacciones químicas en el cuerpo humano, lo que permite a los científicos desarrollar tratamientos más específicos y efectivos. La farmacología se basa en la comprensión de estas reacciones para diseñar medicamentos que interactúen de manera efectiva con los procesos biológicos.
5.3. Seguridad y Manejo de Productos Químicos
El manejo seguro de productos químicos también se basa en la comprensión de la energía en las reacciones químicas. La industria química debe considerar cómo la energía se manifiesta en las reacciones para prevenir accidentes y garantizar un entorno de trabajo seguro. Esto incluye la identificación de reacciones exotérmicas que pueden liberar calor o gases peligrosos y la implementación de medidas de seguridad adecuadas.
Por ejemplo, en la fabricación de explosivos, es crucial entender cómo se manifiesta la energía en las reacciones para controlar y minimizar los riesgos. La formación de protocolos de seguridad y capacitación del personal son esenciales para manejar productos químicos de manera responsable.
Preguntas Frecuentes (FAQ)
1. ¿Qué es la energía de activación en una reacción química?
La energía de activación es la cantidad mínima de energía necesaria para que los reactivos superen la barrera energética y se conviertan en productos. Esta energía permite que las moléculas colisionen con suficiente fuerza para romper los enlaces existentes y formar nuevos enlaces. Cuanto mayor sea la energía de activación, más lenta será la reacción.
2. ¿Cómo afecta la temperatura a las reacciones químicas?
La temperatura tiene un impacto significativo en la velocidad de las reacciones químicas. A medida que aumenta la temperatura, las moléculas adquieren más energía cinética, lo que resulta en un aumento en la frecuencia y energía de las colisiones entre reactivos. Esto generalmente acelera la reacción. Sin embargo, en algunas reacciones, un aumento excesivo de temperatura puede desnaturalizar enzimas o descomponer reactivos.
3. ¿Qué son los catalizadores y cómo funcionan?
Los catalizadores son sustancias que aumentan la velocidad de una reacción química al reducir la energía de activación necesaria para que la reacción ocurra. Funcionan proporcionando un camino alternativo para la reacción que requiere menos energía. Un ejemplo común es el uso de catalizadores en la industria automotriz para reducir las emisiones nocivas de los gases de escape.
4. ¿Qué es una reacción exotérmica?
Una reacción exotérmica es aquella que libera energía al medio ambiente, generalmente en forma de calor o luz. Un ejemplo típico es la combustión de combustibles, donde la energía almacenada en los enlaces químicos se libera al romperse y formar nuevos enlaces con el oxígeno. Este tipo de reacciones es común en procesos de generación de energía.
5. ¿Qué es una reacción endotérmica?
Una reacción endotérmica es aquella que absorbe energía del entorno. Este tipo de reacciones requieren un aporte de energía para llevarse a cabo, lo que puede resultar en una disminución de la temperatura del entorno. Un ejemplo es la disolución de sal en agua o la fotosíntesis, donde se requiere energía solar para convertir el dióxido de carbono y el agua en glucosa.
6. ¿Cuál es la relación entre energía y metabolismo?
El metabolismo se refiere a todas las reacciones químicas que ocurren en un organismo para mantener la vida. Estas reacciones incluyen procesos catabólicos, que liberan energía al descomponer moléculas, y anabólicos, que requieren energía para construir nuevas moléculas. La energía en el metabolismo es crucial para las funciones celulares y el mantenimiento de la homeostasis en los organismos.
7. ¿Por qué es importante la ley de conservación de la energía en las reacciones químicas?
La ley de conservación de la energía es fundamental porque establece que la energía total en un sistema cerrado permanece constante. En el contexto de las reacciones químicas, esto significa que la energía puede transformarse de una forma a otra, pero no se puede crear ni destruir. Este principio nos permite predecir el comportamiento de las reacciones químicas y entender cómo se manifiesta la energía en diferentes procesos.