¿Qué es la Composición de la Materia? Descubre sus Elementos y Estructura
La composición de la materia es un tema fascinante que nos permite entender el mundo que nos rodea. Desde el aire que respiramos hasta los objetos que utilizamos a diario, todo está formado por materia. Pero, ¿qué significa realmente esto? La composición de la materia se refiere a la manera en que se organizan y combinan los diferentes elementos químicos para formar sustancias. Comprender esta composición es esencial para disciplinas como la química, la física y la biología, ya que nos ayuda a desentrañar los secretos de la naturaleza y a desarrollar nuevas tecnologías. En este artículo, exploraremos en profundidad qué es la composición de la materia, sus elementos fundamentales y la estructura que los une. A lo largo de las secciones, descubriremos cómo se organizan los átomos, qué papel juegan las moléculas y cómo se relacionan estos conceptos con nuestra vida cotidiana.
1. Definición de Composición de la Materia
La composición de la materia se refiere a los componentes básicos que constituyen cualquier forma de materia. Cada objeto que vemos y tocamos está hecho de átomos, que son las unidades más pequeñas de un elemento químico. Estos átomos pueden combinarse de diversas maneras para formar moléculas, que son grupos de átomos unidos por enlaces químicos. La manera en que estos átomos y moléculas se organizan y se combinan determina las propiedades físicas y químicas de la materia. La comprensión de la composición de la materia no solo es fundamental en la ciencia, sino que también tiene aplicaciones prácticas en la industria, la medicina y la tecnología.
1.1 Átomos y Elementos
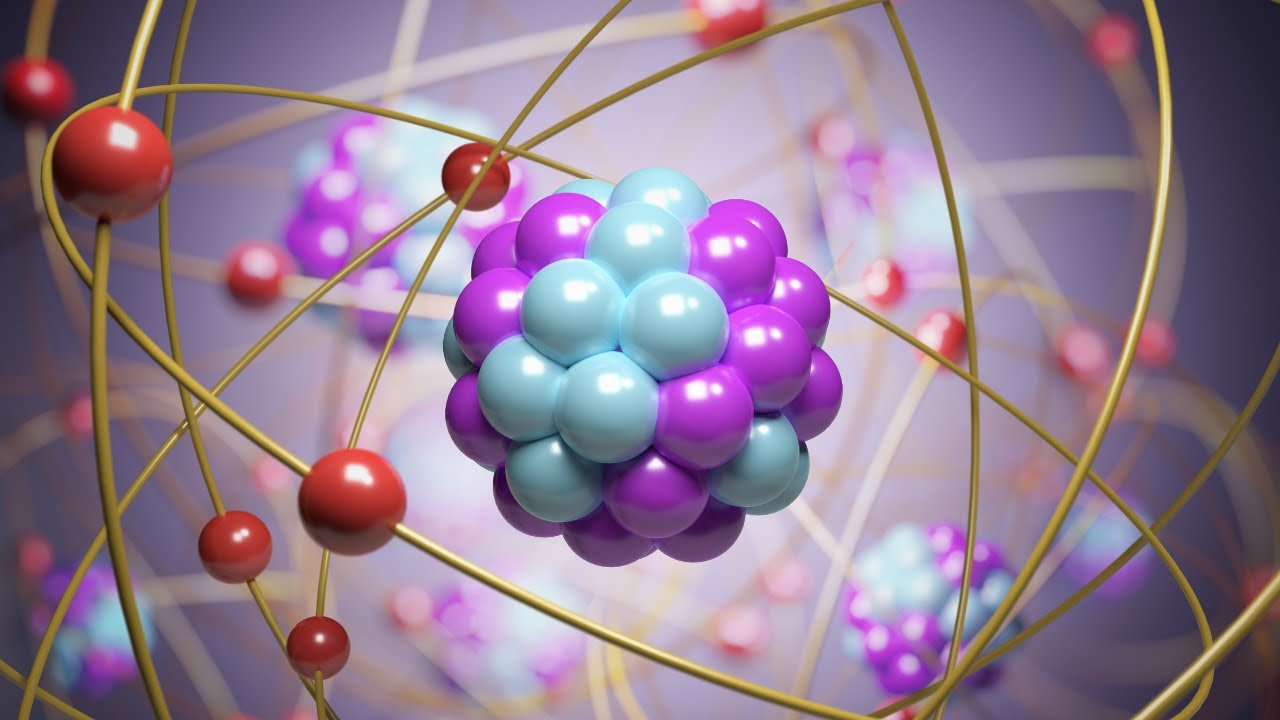
Los átomos son la unidad básica de la materia. Cada átomo está compuesto por un núcleo, que contiene protones y neutrones, y electrones que orbitan alrededor del núcleo. Los elementos son sustancias puras que consisten en un solo tipo de átomo. Por ejemplo, el hidrógeno es un elemento que solo contiene átomos de hidrógeno. Hasta ahora, se han identificado 118 elementos en la tabla periódica, cada uno con propiedades únicas. Algunos elementos son metales, como el hierro y el oro, mientras que otros son no metales, como el oxígeno y el nitrógeno.
1.2 Moléculas y Compuestos
Cuando dos o más átomos se unen, forman moléculas. Estas pueden ser simples, como el oxígeno (O2), que está formada por dos átomos de oxígeno, o más complejas, como el agua (H2O), que está formada por dos átomos de hidrógeno y uno de oxígeno. Los compuestos son un tipo de molécula que contiene átomos de diferentes elementos. Por ejemplo, el cloruro de sodio (NaCl), comúnmente conocido como sal, es un compuesto formado por átomos de sodio y cloro. La forma en que los átomos se combinan y la proporción en que lo hacen afectan las propiedades de la sustancia resultante.
2. La Estructura de los Átomos
Para entender la composición de la materia, es crucial conocer la estructura de los átomos. Cada átomo tiene una estructura única que define sus características y su comportamiento en reacciones químicas. La disposición de los electrones en las capas alrededor del núcleo es lo que determina cómo un átomo interactúa con otros átomos. Esta sección explorará en detalle la estructura atómica y cómo influye en la formación de la materia.
2.1 Núcleo Atómico
El núcleo de un átomo está formado por protones, que tienen carga positiva, y neutrones, que no tienen carga. La cantidad de protones en el núcleo determina el número atómico del elemento, que a su vez define su identidad. Por ejemplo, el carbono tiene seis protones, lo que lo clasifica como el elemento 6 en la tabla periódica. Los neutrones, aunque no afectan la carga del átomo, sí influyen en su masa y en la estabilidad del núcleo. Los isótopos son variantes de un elemento que tienen el mismo número de protones pero diferente número de neutrones, lo que les da propiedades físicas diferentes.
2.2 Electrones y Capas Electrónicas
Los electrones son partículas subatómicas con carga negativa que orbitan el núcleo en diferentes niveles de energía, conocidos como capas electrónicas. La configuración de los electrones en estas capas determina cómo se comporta un átomo en reacciones químicas. Los electrones en la capa más externa, o capa de valencia, son los más relevantes en la formación de enlaces químicos. Por ejemplo, el sodio (Na) tiene un electrón en su capa de valencia, lo que lo hace altamente reactivo, mientras que el neón (Ne) tiene una capa de valencia completa, lo que lo hace inerte.
3. Clasificación de la Materia
La materia se puede clasificar de diversas maneras, pero la más común es en función de su estado físico y su composición. Esta clasificación nos ayuda a entender mejor las propiedades y comportamientos de diferentes sustancias. En esta sección, exploraremos los tres estados de la materia: sólido, líquido y gaseoso, así como la distinción entre mezclas y compuestos.
3.1 Estados de la Materia
La materia existe en tres estados principales: sólido, líquido y gaseoso. En un sólido, las partículas están muy unidas y tienen una forma definida. Por ejemplo, el hielo es agua en estado sólido, donde las moléculas están organizadas en una estructura cristalina. En un líquido, las partículas están más separadas y pueden moverse libremente, lo que permite que los líquidos tomen la forma de su recipiente, como el agua. En un gas, las partículas están aún más separadas y se mueven rápidamente, lo que hace que los gases se expandan para llenar cualquier espacio disponible, como el aire que respiramos.
3.2 Mezclas y Compuestos
Las mezclas son combinaciones de dos o más sustancias que no se combinan químicamente. Por ejemplo, una ensalada es una mezcla de diferentes ingredientes, cada uno conservando sus propiedades individuales. Las mezclas pueden ser homogéneas, donde los componentes son uniformes, como el aire, o heterogéneas, donde se pueden distinguir las diferentes partes, como en un batido. Por otro lado, los compuestos son sustancias formadas por la combinación química de dos o más elementos, como el agua (H2O), que no puede separarse en sus componentes originales mediante métodos físicos.
4. Enlaces Químicos y Reacciones
La forma en que los átomos se combinan y se unen es fundamental para la comprensión de la composición de la materia. Los enlaces químicos son las fuerzas que mantienen unidos a los átomos en las moléculas y compuestos. En esta sección, analizaremos los tipos de enlaces químicos y cómo influyen en las reacciones químicas que transforman la materia.
4.1 Tipos de Enlaces Químicos
Existen varios tipos de enlaces químicos, pero los más comunes son los enlaces covalentes y los enlaces iónicos. Los enlaces covalentes se forman cuando dos átomos comparten electrones. Por ejemplo, en la molécula de agua, los átomos de hidrógeno comparten electrones con el átomo de oxígeno, creando un enlace covalente. Por otro lado, los enlaces iónicos se forman cuando un átomo cede electrones a otro, creando iones que se atraen entre sí debido a sus cargas opuestas. Un ejemplo de esto es el cloruro de sodio (sal), donde el sodio cede un electrón al cloro, formando un enlace iónico.
4.2 Reacciones Químicas
Las reacciones químicas son procesos en los que los enlaces entre los átomos se rompen y se forman nuevos enlaces, resultando en la creación de sustancias diferentes. Estas reacciones son fundamentales en la naturaleza y en la industria. Un ejemplo cotidiano es la combustión, donde el oxígeno reacciona con un combustible, liberando energía y produciendo dióxido de carbono y agua. Las reacciones químicas pueden ser clasificadas en diferentes tipos, como reacciones de síntesis, descomposición y desplazamiento, cada una con sus propias características y productos finales.
5. Importancia de la Composición de la Materia en la Ciencia y Tecnología
Comprender la composición de la materia tiene un impacto significativo en diversas áreas, desde la medicina hasta la ingeniería y la tecnología. Este conocimiento nos permite desarrollar nuevos materiales, medicamentos y soluciones a problemas ambientales. En esta sección, exploraremos algunas aplicaciones prácticas de la comprensión de la composición de la materia.
5.1 Avances en Medicina
La composición de la materia es fundamental en la medicina, ya que nos ayuda a entender cómo interactúan las moléculas en el cuerpo humano. Por ejemplo, el diseño de medicamentos se basa en la comprensión de cómo ciertas moléculas pueden unirse a receptores en las células para desencadenar respuestas biológicas. Además, la investigación en biotecnología utiliza la manipulación de la materia a nivel molecular para desarrollar tratamientos innovadores, como terapias génicas y vacunas.
5.2 Desarrollo de Nuevos Materiales
En el campo de la ingeniería y la tecnología, la composición de la materia es clave para el desarrollo de nuevos materiales. Desde aleaciones metálicas hasta plásticos avanzados, la comprensión de cómo se combinan los átomos y moléculas permite a los científicos e ingenieros diseñar materiales con propiedades específicas, como resistencia, ligereza o conductividad eléctrica. Esto tiene aplicaciones en la fabricación de dispositivos electrónicos, vehículos y estructuras de construcción.
Preguntas Frecuentes (FAQ)
¿Qué es un elemento químico?
Un elemento químico es una sustancia pura que no puede descomponerse en sustancias más simples mediante reacciones químicas. Cada elemento está definido por el número de protones en su núcleo, lo que determina sus propiedades. Los elementos se organizan en la tabla periódica, donde cada uno tiene un símbolo químico único, como H para el hidrógeno y O para el oxígeno.
¿Cuál es la diferencia entre un compuesto y una mezcla?
La principal diferencia entre un compuesto y una mezcla es que un compuesto se forma cuando dos o más elementos se combinan químicamente en proporciones fijas, mientras que una mezcla es una combinación de dos o más sustancias que no se unen químicamente. Por ejemplo, el agua (H2O) es un compuesto, mientras que una ensalada es una mezcla de diferentes ingredientes que conservan sus propiedades individuales.
¿Qué son los isótopos?
Los isótopos son variantes de un mismo elemento que tienen el mismo número de protones pero diferente número de neutrones. Esto significa que tienen la misma carga eléctrica pero diferente masa. Por ejemplo, el carbono tiene isótopos como el carbono-12 y el carbono-14, que se utilizan en datación arqueológica debido a su radiactividad.
¿Por qué es importante la comprensión de la composición de la materia en la vida cotidiana?
La comprensión de la composición de la materia es esencial en nuestra vida cotidiana, ya que influye en todo, desde los alimentos que consumimos hasta los productos que usamos. Por ejemplo, saber cómo se combinan los ingredientes en una receta puede mejorar nuestra cocina, mientras que entender la composición de los productos de limpieza nos ayuda a utilizarlos de manera segura y efectiva.
¿Cómo se forman los enlaces químicos?
Los enlaces químicos se forman a través de la interacción entre los electrones de los átomos. En un enlace covalente, los átomos comparten electrones, mientras que en un enlace iónico, un átomo cede electrones a otro, creando iones que se atraen debido a sus cargas opuestas. La formación de estos enlaces es fundamental para la creación de moléculas y compuestos.
¿Qué son las reacciones químicas y por qué son importantes?
Las reacciones químicas son procesos en los que los enlaces entre los átomos se rompen y se forman nuevos enlaces, resultando en la creación de sustancias diferentes. Son importantes porque permiten la transformación de la materia, lo que es esencial en la naturaleza y en muchas aplicaciones industriales, como la fabricación de productos químicos y medicamentos.